Директор Инновационного Центра
«Биоаквапар — НТЦ аквакультуры» АГТУ
д.б.н, профессор Пономарев С.В.
В условиях резкого снижения запасов рыб осетровых пород, набирающее обороты в последние годы товарное осетроводство является одним из способов производства этой ценной деликатесной продукции. Разработаны и эффективно реализуются различные интенсивные технологии выращивания осетровых рыб, которые предусматривают получение продукции только за счет использования комбинированных кормов (Пономарев и др., 2006; Скляров, 2008; Пономарев, 2009).
Эффективное кормление осетровых рыб в хозяйствах индустриального типа предполагает использование полноценных комбикормов, сбалансированных по составу незаменимых питательных веществ и соответствующих физиологическим потребностям рыбы на разных стадиях развития. Разработка рецептур комбикормов является важной и весьма сложной научной проблемой (Чернышев, 2000; Пономарев и др., 2009; Гамыгин, 2013).
При современном состоянии рынка рыбных комбикормов рыбоводы могут выбирать корма из трех групп:
— зерно злаковых и бобовых культур, жмыхи, шроты, отруби, пивная дробина, сорная рыба и т.д. Они чаще всего доступны в сельской местности и недороги. В основном используются на мелких крестьянско-фермерских хозяйствах при прудовом выращивании. Однако такие корма не сбалансированны по питательным веществам и могут не удовлетворять потребностям в них осетровых рыб;
— кормосмеси или гранулированные корма, вырабатываемые в небольших кормоцехах. Они могут сбалансированные не только по питательным веществам, но и по витаминам и микроэлементам. Качество таких кормов находится в зависимости от возможности выбора сырья и максимально допустимой цены готового корма;
— специализированные корма, производимые на заводах крупных иностранных фирм производителей: Skretting, AllerAqua, LeGouessant, BioMar и т.д. Полнорационные корма характеризуются высоки качеством, а значит, и соответствующей ценой, на которую, кроме того, накладываются транспортные расходы (Захаров, 2010; Пономарев, 2011).
Основными задачами разработки новых рецептур комбикормов является их совершенствование путем повышения продуктивных свойств, удешевления, замены дефицитных компонентов на нетрадиционное сырье (Гамыгин и др., 1989).
Высокая продуктивность и рациональное использование кормов возможны лишь в том случае, когда объекты рыбоводства полностью обеспечены необходимым количеством протеина, жира, углеводов, минеральных веществ, витаминов и получают достаточное количество энергии для осуществления своих жизненных функций (Скляров и др., 1984; Абросимова и др., 2005; Пономарев и др., 2007; Остроумова, 2012; Пономарев и др., 2013).
Знание особенностей питания и кормления осетровых рыб дает возможность более рационально использовать искусственные корма.
Целью работы явилось изучение эффективности замены рыбной муки (50 и 100%) в составе полнорационного комбикорма для осетровых рыб, а также добавки пробиотика, разработанного ИПЭЭ РАН.
Для этого следовало решить следующие задачи:
— скорректировать рецептуру полнорационного комбикорма с введением сухой биомассы из личинок насекомых и пробиотика;
— изготовить опытные партии кормов с заменой 50 и 100% рыбной муки на сухую биомассу и добавкой пробиотика;
— провести опытные испытания кормов на молоди русского осетра в условиях УЗВ;
— оценить продуктивное действие кормов на рыбу.
1 Материалы и методы
Объектом исследования послужила молодь русского осетра (Acipenser gueldenstaedti Brandt, 1833) средней массой 400 г.
Экспериментальные работы проводили на базе Инновационного центра «Биоаквапарк – НТЦ аквакультуры» ФГБОУ ВПО «Астраханский государственный технический университет». Для содержания молоди использовались бассейны с прямоточным водоснабжением искусственной аэрацией и фильтрацией. Температура воды в период постановки эксперимента была в пределах 15-19°С, именно при таких значения осетровые рыбы активно растут и потребляют искусственные комбикорма.
Содержание кислорода в воде устанавливали ежедневно три раза в сутки (для предупреждения нежелательных колебаний) с помощью термооксиметра «Сyber Scan DO 300». Значения рН определяли с помощью рН-метра марки «Hanna». Кроме этого 3 раза в сутки регистрировали температуру воды.
При оценке влияния кормов на статус выращенных рыб применяли комплекс рыбоводно-биологических и физиолого-биохимических методов (Пономарев и др., 2002). Взвешиваниям и измерениям подвергали всю рыбу, находившуюся в экспериментах. Опытные корма изготавливали в лабораторных условиях с использованием кормовых компонентов отечественного производства (на все компоненты получены удостоверения качества и безопасности и сертификаты соответствия) методом влажного прессования при низком давлении. Компоненты растительного происхождения были подвергнуты предварительной микронизации для клейстеризации крахмала (процесс аналогичен экструзии), что повышает его перевариваемость и питательную ценность. После этого все компоненты взвешивали на электронных весах, а затем тщательно перемешивали с водой до однородной массы, после чего влажную смесь пропускали через мясорубку, высушивали в термостате при температуре 600С. Готовые комбикорма измельчали в дробилке и рассеивали в соответствии с необходимым размером крупки, который устанавливали в соответствии с массой выращиваемой рыбы. Рецептура комбикорма для осетровых рыб с добавление сухих личинок и пробиотика представлена в таблице 1.
Таблица 1 – Состав продукционных комбикормов для осетровых рыб с добавлением сухих личинок и пробиотика
| Ингредиенты, % | Варианты опыта | |
| контроль | опыт 1 | |
| Мука рыбная | 50 | |
| Соевый шрот | 13 | |
| Кукурузный глютен | 10 | |
| Гороховый протеин | 20 | |
| Рыбий жир | 6,0 | |
| Премикс | 1,0 | |
| Личинки + пробиотик | + | |
| Состав питательных веществ, % | ||
| Протеин | 49,0 | |
| Жир | 10,0 | |
| Углеводы | 21,7 | |
| Минеральные вещества | 10,0 | |
| Влага | 8,5 | |
| Клетчатка | 0,8 | |
Рецептуры комбикормов с заменой рыбной муки на сухую биомассу личинок насекомых представлены в таблице 2.
| Ингредиенты, % | Варианты опыта | |||
| контроль | опыт 1 (полная замена рыбной муки) | опыт 2 (частичная замена рыбной муки) | ||
| 1 | 2 | 3 | 4 | |
| Мука рыбная | 50 | — | 25 | |
| Соевый шрот | 13 | 13 | 13 | |
| Кукурузный глютен | 10 | 10 | 10 | |
| Гороховый протеин | 20 | 20 | 20 | |
| Рыбий жир | 6,0 | 6,0 | 6,0 | |
| Премикс | 1,0 | 1,0 | 1,0 | |
| Сухая биомасса личинок насекомых | — | 50 | 25 | |
| Состав питательных веществ, % | ||||
Продолжение таблицы 2
| 1 | 2 | 3 | 4 |
| Протеин | 49,0 | 48,0 | 52,0 |
| Жир | 10,0 | 15,0 | 12,0 |
| Углеводы | 21,7 | 21,7 | 21,7 |
| Минеральные вещества | 10,0 | 10,0 | 10,0 |
| Влага | 8,5 | 8,5 | 8,5 |
| Клетчатка | 0,8 | 0,8 | 0,8 |

Рисунок 1 – Сухая биомасса личинок насекомых
Схема измерений рыб проводилась по методике Правдина И.Ф. (1966).
Среднесуточную скорость роста молоди вычисляли по формуле сложных процентов (Castell, Tiews, 1979):
А =[( mк /mо )1/t – 1] х 100 (%)
где mк и mо — масса рыбы в конце и в начале опыта;
t – продолжительность опыта, сут.
Абсолютный прирост вычисляли по формуле (Правдин, 1966):
Раб = mк – m0
где mк — конечная масса молоди, грамм;
m0 – начальная масса молоди, грамм.
Среднесуточный прирост вычисляли по формуле (Правдин, 1966):
Рср.сут. = (mк – m0)/t
где mк — конечная масса молоди, грамм;
m0 – начальная масса молоди, грамм.
t – продолжительность опыта, сут.
Кормовые затраты вычисляли по формуле (Пономарев и др., 2002):
Кз= Ск/( mк – m0),
где Ск – количество корма, затраченное на выращивание рыб (затраты корма на единицу прироста).
Ск=R*mср.нач*t
где R – суточная норма корма, %; mср.нач – средняя начальная масса, г; t- период выращивания.
Коэффициент упитанности определяли по формуле Фультона (1902):
КФ = m/l3*100%,
где m — масса рыбы, г,
l — длина от начала рыла до конца чешуйного покрова, см.
Выживаемость выражали в процентах от общего количества наблюдаемых рыб.
Корм задавался вручную 3 раза в сутки. Плотность посадки молоди устанавливали исходя из массы выращиваемой рыбы.
Гематологические исследования проводились согласно «Методическим указаниям по проведению гематологического обследования рыб» (Утвержденные 2 февраля 1999 г., №13-4-2/1487).
Для гистологического анализа брали половые продукты самок, фиксировали в смеси Буэна, заливали в парафин и изготавливали срезы толщиной 7 мкм (Микодина и др., 2009). Полученные срезы окрашивали гематоксилин-эозином и фотографировали на микроскопе Olimpus BX 53.
Опыты по определению интенсивности роста и созревания проводили в двукратной повторности. Все данные подвергали статистической обработке по Г.Ф. Лакину (1990) с применением панели программ статанализа Excel. При этом использовали элементы статистического анализа с определением средней, ошибки средней. Уровень различий оценивали с помощью критерия достоверности Стьюдента.
3 Результаты исследований
3.1 Влияние пробиотика на репродуктивную функцию осетровых рыб
В настоящее время в качестве средства, направленного на поддержание и восстановление нормального физиологического состояния человека и животных используют различные пробиотические препараты. Это связано с современным состоянием антибиотикорезистентности рыб, которая делает необходимым поиск альтернативных, физиологически обоснованных и безопасных средств для профилактики и лечения инфекций.
В связи с этим, основной проблемой интенсивного осетроводства является разработка новых биотехнологий выращивания, с использованием комбикормов, содержащих в своем составе современные препараты пробиотиков.
За период исследований с 30 апреля по 26 мая 2015 г. (30 суток) в контроле и опытном варианте наблюдался прирост массы, однако в опытном варианте он был выше, чем в контрольной группе. Выживаемость во всех бассейнах была 100%-ной.
Лучшие рыбоводно-биологические показатели по результатам выращивания показала опытная группа рыб, потреблявшая комбикорм с добавлением пробиотика и личинки. За 30 суток абсолютный прирост в этой группе составил 92,87 г, что на 24,01 г выше, чем в контроле. Весовой рост при кормлении молоди кормом с добавлением личинок и пробиотика шел интенсивнее, чем в контроле. Так, коэффициент упитанности в опыте составил 0,72%, в контроле – 0,71% (табл. 3).
Показатели среднесуточного прироста и среднесуточной скорости роста также были выше у рыб из опытной группы и составили 3,1 г и 0,69%, соответственно. В то время как в контрольной группе они были ниже на 0,8 г и 0,17%.
Таблица 3 – Рыбоводно-биологические показатели выращивания молоди русского осетра
| Показатели | Варианты эксперимента | |
| Контроль | Опыт – корм с добавлением пробиотика и личинки | |
| Масса, г: начальная конечная | 400,47+5,08 469,33+3,74 | 401,2+4,43 494,07±5,26* |
| Длина, см: начальная конечная | 33,8±0,81 40,5±1,18 | 33,5±0,86 41,0±1,01 |
| Коэффициент упитанности по Фультону, % | 0,71 | 0,72 |
| Абсолютный прирост, г | 68,86 | 92,87 |
| Среднесуточный прирост, г | 2,3 | 3,1 |
| Среднесуточная скорость роста, % | 0,52 | 0,69 |
| Коэффициент массонакопления, ед | 0,038 | 0,051 |
| Кормовой коэффициент | 1,1 | 1,0 |
| Выживаемость, % | 100 | 100 |
Примечание: * различия достоверны при р< 0,001
В ходе разработки кормовых рационов, в частности при составлении рецептов сбалансированных полноценных сухих гранулированных комбикормов, необходимо осуществлять физиологический контроль за состоянием выращиваемых рыб, сопоставляя данные анализа красной крови. По физиологическому состоянию рыбы, которое характеризует и кровь, можно говорить о полноценности потребляемых комбикормов. Так, в ходе изучения физиологического состояния опытных групп рыб, потреблявших сухие комбикорма, определена группа показателей, которые определяют неполноценность пищи. Одними из наиболее важных показателей, являются показатели красной крови, в частности содержание гемоглобина и общего белка. Полная оценка состава крови показала свою надежность, особенно при разработке рецептов сухих гранулированных сбалансированных комбикормов для осетровых рыб. При этом наиболее показательными являются данные содержания гемоглобина. В естественной среде у осетровых рыб нормой принято считать следующие значения физиологических показателей: гемоглобин – 50–80 г/л, сывороточный белок – 28–40 г/л, сывороточные липиды – 3–4 г/л, холестерин – 1–2,8 ммоль/л, СОЭ – 2–4 мм/час (Металлов и др., 2010).
Из таблицы 4 видно, что по основным гематологическим показателям физиологическое состояние молоди находилось в пределах нормы. У рыб, потреблявших корм с добавлением личинки и пробиотика гемоглобин повысился с 65,15±8,93 г/л до 77,41±2,56г/л. В контрольном варианте значительных изменений по гемоглобину отмечено не было. Самая высокая скорость оседания эритроцитов наблюдалась перед началом выращивания у опытной группы.
Концентрация сывороточного белка, как в контроле, так и в опыте колебалась в пределах нижней границы нормы, характерной для рыб из естественных водоёмов (25–40 г/л). Относительно низкий уровень сывороточного белка часто наблюдается у молоди осетровых при выращивании в условиях рыбоводных заводов.
Таблица 4 — Гематологические показатели при выращивании гибрида с добавлением пробиотических препаратов в кормовую смесь
| Показатели | Варианты эксперимента | |
| Контроль | Опыт – корм с добавлением пробиотика и личинки | |
| 1 | 2 | 3 |
| Начало эксперимента | ||
| Гемоглобин, г/л | 63,54±6,6 | 65,15±8,93 |
| СОЭ, мм/ч | 2,6±0,2 | 2,8±0,27 |
| Сывороточный белок, г/л | 28,27±1,84 | 28,76±1,8 |
| Сывороточные липиды, г/л | 3,5+0,15 | 3,5+0,1 |
| Холестерин, ммоль/л | 1,9+0,01 | 1,8+0,12 |
| Конец эксперимента | ||
| Гемоглобин, г/л | 63,37±1,8 | 77,41±2,56* |
| СОЭ, мм/ч | 4,35+0,31 | 3,21+0,44** |
Продолжение таблицы 4
| 1 | 2 | 3 |
| Сывороточный белок, г/л | 32,72±1,68 | 32,7±1,44 |
| Сывороточные липиды, г/л | 3,6+0,15 | 3,5+0,22 |
| Холестерин, ммоль/л | 2,21+0,24 | 2+0,5 |
Примечание: * различия достоверны при р< 0,001; р< 0,05
Возможно, это связано как со спецификой питания, так и с уровнем стрессовой нагрузки, которая всегда присутствует при содержании рыбы в прудах или бассейнах. Это приводит к излишним тратам легко реализуемого в процессе обмена такого биохимического субстрата, как белок. Дополнительная энергия в этом случае используется для преодоления стресса.
Использование пробиотика в комбикормах при выращивании осетровых рыб оказывало положительное влияние на развитие половых продуктов, в частности у самок. Длина яйцеводов у опытной группы составила 6,15 см, контрольной – 6 см. Различия не значительные, т.к. длина яйцевода напрямую зависит от длины тела самки. Масса яичников опытной группы составил 20 г, контрольной группы на 5 г меньше. Ширина яичников также была больше у самок опытной группы и составила 1,1 см, в то время как в контроле этот показатель составлял 0,7 см.
Так же по окончанию эксперимента были проведены гистологические исследования половых продуктов у самок опытной группы (рис. 2).
У исследованных самок опытной группы половые ганады находились на II стадии зрелости. Яйценосные пластинки были хорошо сформированы. На гистологических препаратах были видны многочисленные ооциты различных ступеней протоплазматического роста, составляющие старшую генерацию половых клеток. Развитие их протекало без видимых отклонений (за исключением незначительного числа деформированных).
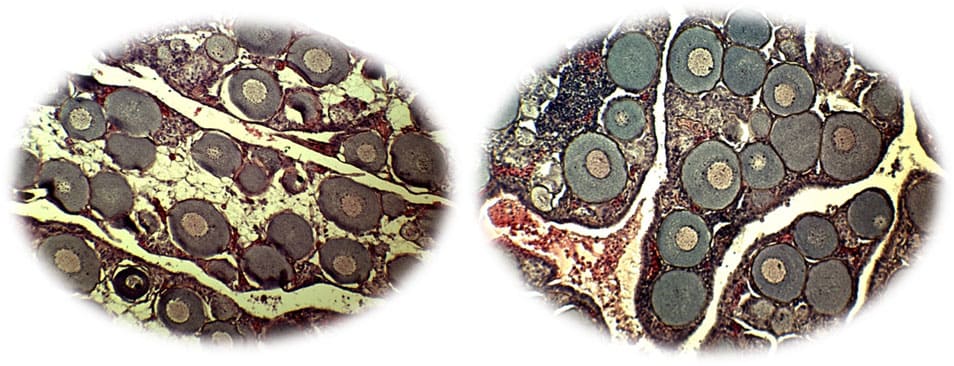
Рисунок 1 — Яичник самки русского осетра II СЗГ (2-хлетки). Окраска гематоксилин-эозином. Ув. 22х10. 1
Полученные рыбоводно-биологические, гематологические и гистологические результаты говорят об эффективности использования комбикорма с добавлением личинок и пробиотика.
3.2 Эффективность замены рыбной муки на сухую биомассу личинок насекомых
Лучшие рыбоводно-биологические показатели по результатам выращивания показали опытные группы рыб, потреблявшая комбикорм с добавлением сухой биомассы личинок насекомых. За 30 суток абсолютный прирост в этих группах составил 69,5 г (опыт 1) и 93,61 г (опыт 2), соответственно, превысив показатели контрольного варианта на 10,44 и 34,55 г. Весовой рост при кормлении молоди русского осетра кормом с частичной и полной заменой рыбной муки на сухую биомассу личинок шел интенсивнее, чем в контроле, как и линейный (табл. 5).
Таблица 5 – Рыбоводно-биологические показатели выращивания молоди осетровых рыб на опытных группах комбикормов
| Показатели | Варианты эксперимента | ||
| Контроль | опыт 1 (полная замена рыбной муки) | опыт 2 (частичная замена рыбной муки) | |
| Масса, г: начальная конечная | 402,07+8,53 461,13+5,5 | 401,1+5,15 470,6+3,5 | 401,34+5,48 494,95+3,1* |
| Длина, см: начальная конечная | 33,5+0,81 40,19+2,1 | 35,1+0,11 41,4+1,1 | 34,2+0,9 41,0+0,18 |
| Коэффициент упитанности по Фультону, % | 0,7 | 0,66 | 0,72 |
| Абсолютный прирост, г | 59,06 | 69,5 | 93,61 |
| Среднесуточный прирост, г | 1,97 | 2,32 | 3,12 |
| Среднесуточная скорость роста, % | 14,41 | 15,02 | 16,16 |
| Коэффициент массонакопления, ед | 0,034 | 0,039 | 0,052 |
| Кормовой коэффициент | 1,1 | 1,09 | 1,05 |
| Выживаемость, % | 100 | 100 | 100 |
Примечание: различия достоверны при р<0,001
Кормовой коэффициент, который характеризует конверсию корма, в контрольном и опытных вариантах не превышал 1,1. Лучшее усвоение корма показал вариант с использованием сухой биомассы личинок.
Таким образом, по данным биологических показателей роста, выживаемости можно говорить о положительном результате выращивания молоди осетровых рыб на разработанных продукционных кормах. Также по итогам выращивания молоди в индустриальных условиях отмечено, что возможна как полная, так и частичная замена рыбной муки на сухую биомассу личинок насекомых, что не снижает показатели выживаемости и темпов роста данного вида.
Для оценки физиологического состояния рыб во всех вариантах экспериментов был выполнен анализ гематологических показателей (табл. 6).
Таблица 6 – Гематологические показатели выращивания молоди осетровых рыб на опытных комбикормах
| Показатели | Варианты эксперимента | ||
| Контроль | опыт 1 (полная замена рыбной муки) | опыт 2 (частичная замена рыбной муки) | |
| Начало эксперимента | |||
| Гемоглобин, г/л | 65,11±4,3 | 64,01±5,15 | 65,33+8,01 |
| СОЭ, мм/ч | 2,4±0,21 | 2,55±0,34 | 2,64+0,28 |
| Сывороточный белок, г/л | 30,41±2,84 | 30,57±2,01 | 30,71+1,28 |
| Сывороточные липиды, г/л | 3,61+0,21 | 3,58+0,18 | 3,60+0,27 |
| Холестерин, ммоль/л | 2,1+0,1 | 2,05+0,18 | 2,12+0,21 |
| Конец эксперимента | |||
| Гемоглобин, г/л | 65,49±2,01 | 75,41±2,98* | 75,1+3,15** |
| СОЭ, мм/ч | 3,9+0,11 | 3,55+0,81 | 3,6+0,12 |
| Сывороточный белок, г/л | 35,52±1,99 | 37,2±1,53 | 37,5+1,88 |
| Сывороточные липиды, г/л | 3,6+0,15 | 3,5+0,21 | 3,5+0,48 |
| Холестерин, ммоль/л | 2,11+0,34 | 2,2+0,51 | 2,3+0,64 |
Примечание: различия достоверны при * р<0,01; ** р<0,05;
Обеспеченность рыбы гемоглобином определяется температурой воды. Выращивание рыбы в условиях пониженного содержания кислорода сопровождается увеличением общего объема крови, плазмы, что повышает эффективность газообмена.
Для осетровых рыб скорость оседания эритроцитов (СОЭ) в норме соответствует 2-4 мм/ч, при этом ее повышение указывает на наличие воспалительного процесса. В нашем случае данный показатель во всех опытных вариантах и контроле находился в пределах 3,55-3,9 мм/ч.
Согласно литературным данным концентрация сывороточного белка в норме для осетровых рыб находится в пределах 28-40 г/л (Металлов и др., 2010). Более низкое содержание белка может говорить о том, что имеют место излишние траты легко реализуемого в процессе обмена такого биохимического субстрата, как белок. Дополнительная энергия в этом случае используется для преодоления стресса. Увеличение содержания общего белка в крови говорит о питательности корма, способствующее увеличению привеса, в результате наращивания мышечной массы, а, следовательно, и более быстрому росту рыб. В опытных вариантах показатели сывороточного белка крови были самыми высокими – 37,2 и 37,5 г/л, соответственно.
В норме, холестерин в крови у осетровых находится в пределах 1–2,8 ммоль/л. Его повышение говорит о наличии стрессовой ситуации у рыб. В контрольном и опытных вариантах, содержание холестерина было в норме, и не превышало критические пределы.
Липиды выполняют в организме животных разнообразные функции и служат основным источником энергии. Триглицериды являются основным хранилищем липидов. Направленность жирового обмена у рыб способствовала нормальному процессу накопления энергетических ресурсов, о чем свидетельствует уровень липидов не превышающий норму 3-4 г/л . Увеличение содержание триглицеридов в крови, свидетельствует о нарушении липидного обмена в организме или о нарушении функции печеночных клеток. Из таблицы 6 видно, что количество во всех вариантах было в пределах нормы.
Заключение
Полученные в ходе проведенных исследований данные позволяют рекомендовать введение в состав продукционных кормов для осетровых рыб при их товарном выращивании пробиотические препараты совместно с сухой биомассой из личинок насекомых, что повышает показатели роста, снижает кормовые затраты, а также поддерживает физиологическое состояние рыб на соответствующем нормам уровне.
Как показали результаты, 50 и 100% замена рыбной муки на сухую биомассу из личинок насекомых в комбикорме для молоди осетровых рыб оказала положительное действие на комплекс рыбоводно-биологических показателей при выращивании в индустриальных условиях: абсолютный и относительный приросты, среднесуточную скорость роста, коэффициент массонакопления, несколько снизила кормовые затраты и сохранила высокую выживаемость.
Список литературы:
- Абросимова Н.А. Кормовое сырье и добавки для объектов аквакультуры / Н.А. Абросимова, С.С. Абросимов, Е.М. Саенко. – Ростов-на-Дону: Эверест, 2005. – 144 с.
- Гамыгин Е.А. Комбикорма для рыб / Е.А. Гамыгин, В.Я. Лысенко, В.Я. Скляров, В.И. Турецкий. — М.: Агропромиздат, 1989. — 168 с.
- Гамыгин Е.А. Некоторые аспекты проблем кормов и кормопроизводства для рыб на современном этапе / Е.А. Гамыгин, А.М. Багров. Доклады Междунар. научн.-практич. конф.: Состояние и перспективы развития пресноводной аквакультуры (Москва, ВВЦ, 5-6 февраля 2013 г.). – М.: Изд-во РГАУ МСХА им. К.А. Тимирязева, 2013. – С. 53-57.
- Захаров В.В. Комбикорма для товарного рыбоводства / В.В. Захаров. – Комбикорма. 2010. № 6. – С. 34-35.
- Лакин Г.Ф. Биометрия: Учебное пособие для биологических специальностей вузов – 4-е издание, перераб. и допол. / Г.Ф. Лакин. – М.: Высшая школа, 1990. – 352 с.
- Металлов Г.Ф. Физико-биологические механизмы эколого-адаптационной пластичности осморегулирующей системы осетровых рыб / Г.Ф. Металлов, С.В. Пономарев, В.П. Аксенов, П.П. Нераскин. — моногр. — Астрахан.гос. тех. ун-т. – Астрахань: Изд-во АГТУ, 2010. – 192 с.
- Методические указания по проведению гематологического обследования рыб / Утвержденные зам. руководителя Департамента ветеринарии В.В. Селиверстовым 2 февраля 1999 г. №13-4-2/1487.
- Микодина Е.В. Гистология для ихтиологов: Опыт и советы./ Е.В. Микодина, М. А. Седова, Д.А. Чмилевский, А.Е. Микулин, С.В. Пьянова, О.Г. Полуэктова. – М.: Изд-во ВНИРО. – 2009. – 112 с.
- Остроумова И.Н. Биологические основы кормления. Изд-е 2-е, испр. и доп. / И.Н. Остроумова. – СПб.: ГосНИОРХ, 2012. – 564 с.
- Пономарев С.В. Индустриальное рыбоводство / С.В. Пономарев, Ю.Н. Грозеску, А.А. Бахарева. – М.: Колос, 2006. – 320 с.
- Пономарев С.В. Корма и кормление рыб в аквакультуре: Учебник / С.В. Пономарев, Ю.Н. Грозеску, А.А. Бахарева. – М.: МОРКНИГА, 2013. – 417 с.
- Пономарев С.В. Продукты глубокой переработки крабов в комбикормах для объектов аквакультуры/ С.В. Пономарев, Е.А. Гамыгин, Е.Н. Пономарева, Ю.В. Сергеева. – Астрахань: Изд-во АГТУ, 2007. – 116 с.
- Пономарев С.В. Результаты научной оценки эффективности и продуктивного действия новых продукционных комбикормов зарубежного производства в условиях хозяйств с естественным и регулируемым термическим режимом выращивания / С.В. Пономарев, Ю.Н. Грозеску, Е.Н. Пономарева, В.В. Чалов, Ю.М. Баканева, Н.В. Болонина, В.Г. Чипинов, Р.Б. Абсалямов, М.В. Коваленко. Вестник АГТУ. Сер.: Рыбное хоз-во, 2009. № 2. – С. 102-108.
- Пономарев С.В. Современные корма для осетровых рыб / С.В. Федоровых, Ю.В. Федоровых. Материалы Международной научной конференции: Актуальные проблемы обеспечения продовольственной безопасности юга России: инновационные технологии для сохранения биоресурсов, плодородия почв, мелиорации и водообеспечения (27-30 сентября 2011г., г. Ростов-на-Дону). – Ростов-н/Д: Изд-во ЮНЦ РАН, 2011. – С. 95-96.
- Пономарев С.В. Технологии выращивания и кормления объектов аквакультуры юга России / С.В. Пономарев, Е.А. Гамыгин, С.И. Никоноров, Е.Н. Пономарева, Ю.Н. Грозеску, А.А. Бахарева. — Астрахань: «Нова плюс», 2002.- 264 с.
- Правдин П.Ф. Руководство по изучению рыб / П.Ф. Правдин. — М.: Пищ. пром-ть, 1966. — 250 с.
- Привезенцев Ю.А. Тиляпии (систематика, биология, хозяйственное использование)/ Ю.А. Привезенцев – М.: ООО «Столичная типография», 2008.– 80 с.
- Скляров В.Я. Корма и кормление рыб в аквакультуе / В.Я. Скляров. – М.: Изд-во ВНИРО, 2008. – 149 с.
- Скляров В.Я. Справочник по кормлению рыб / В.Я. Скляров, Е.А. Гамыгин, Л.П. Рыжков. — М.: Легкая и пищ. пром-ть, 1984. — 120 с.
- Скляров В.Я., Дюндик О.Б. Корма для тиляпии // Рыбоводство и рыболовство. — №2. – 1995. – С.21.
- Чернышев Н.И. Компоненты комбикормов / Н.И. Чернышев, И.Г. Панин. – Воронеж: ГУП «Старооскольская типография», 2000. – 121 с.
- Castell J.D. Report of the EIFAC, IUNS and ICES Working Group on the standardization of the methodology in fish nutrition research / J.D. Castell, K. Tiews // Hamburg (Federal Republic of Germany, March 21-23, 1979) EIFAC Tech. pap. 36. 1979. P. 1-24.
- Fulton T. Rate of growth of sea fish. Fish. Scotl. Sci. Invest. Report, v. 20,pt 3. 1902. 226- 334.
- Kanazawa A., Teshima S., Sakamoto M. 1982. Requirements of essential fatty acids for the larval ayu.B. Jap.Soc.Sci.Fish. 48: 586-590
- Takeuchi, L., Takeuchi, T. y Ogino, C.1980. Riboflavin requirements in carp and rainbow trout.Bull. Jap. Soc. Sci. Fish., 46:733–737.


